chlor
Anorganická chemie / Chemické prvky
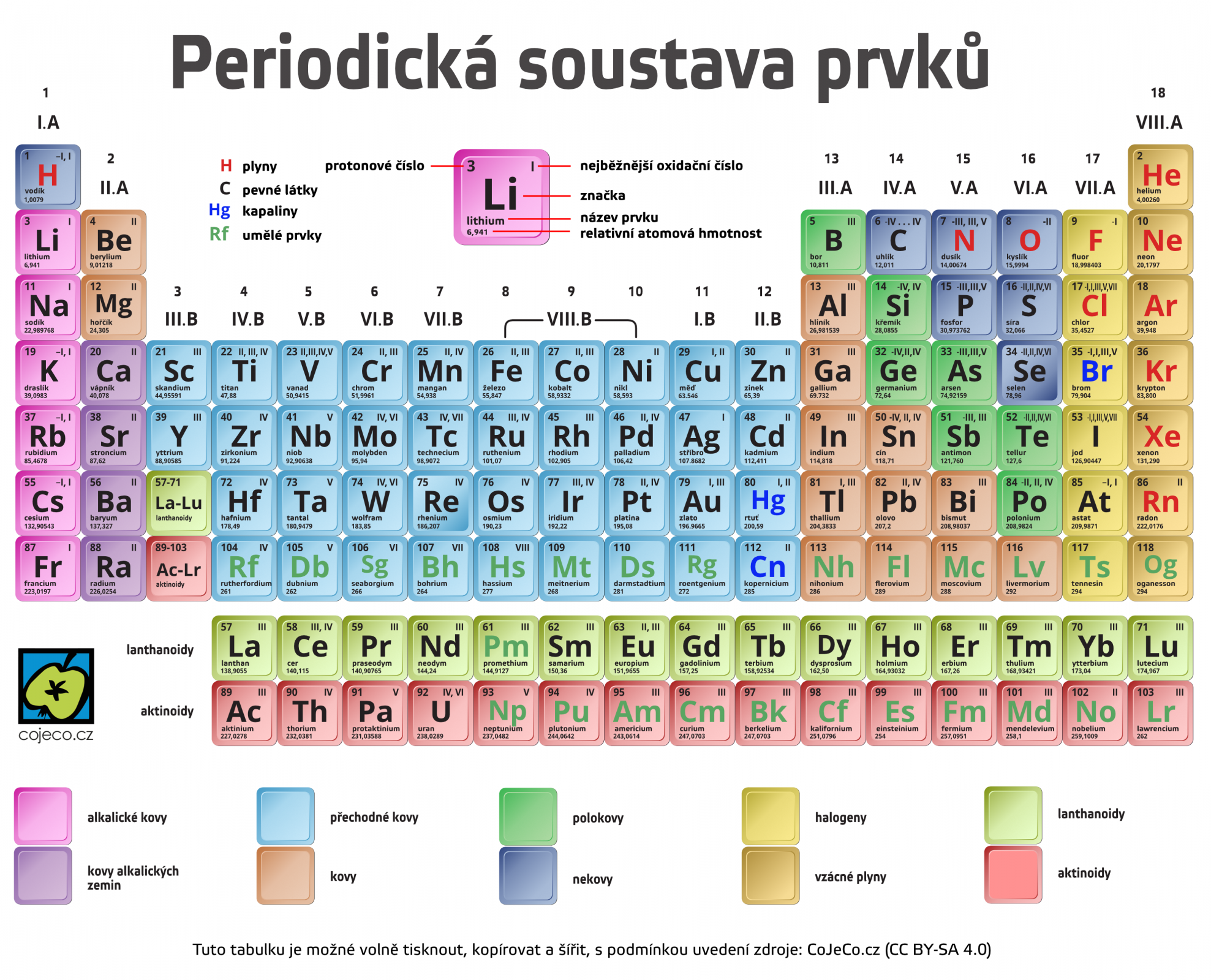
Chlor, chlorum, Cl, chemický prvek VII.A skupiny periodické soustavy, patří mezi halogeny. Protonové číslo 17, relativní atomová hmotnost 35,453. Teplota tání je -100,5°C, teplota varu je -34°C, hustota 3,18kg/m3. Chlor byl objeven roku 1774. Chlor je žlutozelený, štiplavě páchnoucí, velice reaktivní plyn. Je méně reaktivní než fluor, přesto se slučuje s celou řadou kovů i nekovů. Železo a měď se suchým chlorem nereagují. Chlor se přímo neslučuje jen s kyslíkem, dusíkem, ušlechtilými kovy a vzácnými plyny. V přírodě se vyskytuje ve formě chloridů, například v solných ložiscích a mořské vodě. Vyrábí se elektrolýzou NaCl. Chlor se používá v organické syntéze, chemické výrobě (HCl, PVC), při výrobě papíru, v textilním průmyslu, k dezinfekci pitné vody. Ve sloučeninách má oxidační číslo -I, I, III, IV, V, VI, VII. Ze sloučenin chloru jsou nejdůležitější chlorovodík (kys. chlorovodíková), chlorečnany, chloridy. V živém organismu je nezbytný pro vodní a acidobazickou rovnováhu a pro regulaci osmotického tlaku, důležitý je i pro tvorbu kyseliny chlorovodíkové v žaludeční šťávě. Chlor je jedovatý, silně leptá sliznice.
Vytvořeno:
21. 11. 2000
Aktualizováno:
13. 8. 2021
Autor: -DK-
Odkazující hesla: aktivační energie, amonizace, atmosférická koroze, brom, chlorhydriny, chlorid fosforitý, chlorová voda, Cl, elektrolýza soli, halogeneze, halogeny, periodická soustava prvků, sulfochlorace, Ypres.
Vyzkoušejte si s přáteli Kvízy encyklopedie CoJeCo.cz!