lithium
Anorganická chemie / Chemické prvky
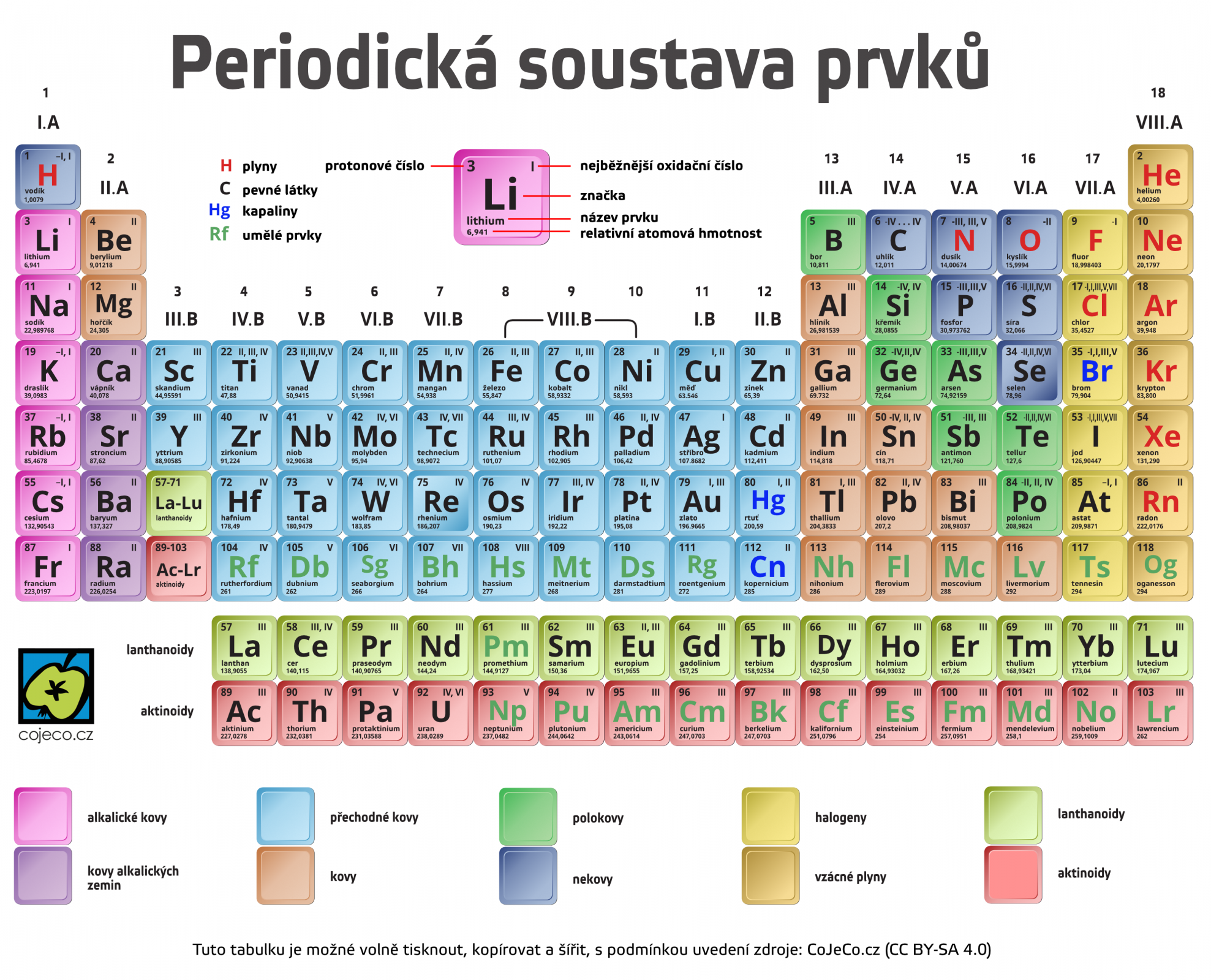
[Lítyum, řečtina], Li, chemický prvek I.A skupiny periodické soustavy, patří mezi alkalické kovy. Protonové číslo 3, relativní atomová hmotnost 6,941. Teplota tání je 180°C, teplota varu 1372°C, hustota 534 kg/m3. Lithium bylo objeveno roku 1817. Je to měkký lehký stříbrobílý reaktivní kov. Jeho reaktivita je však mnohem menší než u ostatních alkalických kovů. Zbarvuje bezbarvý plamen karmínově, na vlhkém vzduchu se pokrývá vrstvou hydroxidu, při zvýšené teplotě na vzduchu shoří na oxid lithný, znečištěný peroxidem. S vodou reaguje za vzniku hydroxidu a uvolnění vodíku. V přírodě se v elementární formě nevyskytuje a jeho nerosty jsou vzácné. Nejdůležitějšími minerály obsahujícími lithium jsou lepidolit Li2(F,OH)2Al2.(SiO3)3 a spodumen LiAl(SiO3)2. Vzhledem k vysokému standardnímu potenciálu není možné připravit kov elektrolýzou vodných roztoků lithných solí, takto vzniká pouze hydroxid. Kov se vyrábí elektrolýzou chloridu lithného LiCl v pyridinu, ethanolu nebo acetonu. Používá se jako příměs do slitin hliníku, zinku a hořčíku a v metalurgii mědi, jako náplň do termojaderných náloží. Ve sloučeninách má oxidační číslo I. Většina sloučenin lithia je dobře rozpustná ve vodě. Lithium a jeho sloučeniny jsou jedovaté.
Vytvořeno:
14. 3. 2000
Aktualizováno:
18. 6. 2024
Autor: -red-
Odkazující hesla: alkalické kovy, alkalický, lepidolit, Li-Ion, lithiová hvězda, periodická soustava prvků, rubelit, silicidy, tritium.
Vyzkoušejte si s přáteli Kvízy encyklopedie CoJeCo.cz!